作为医疗器械上市的审批单位,美国食品药品监督管理局(FDA)从2018年开始设立了“突破性设备”计划,用以鼓励创新医疗器械的创新发展。截至2022年底,共计有760款医疗器械被纳入“突破性设备”名单,而在今年上半年,通过“突破性设备认定”的有32项。
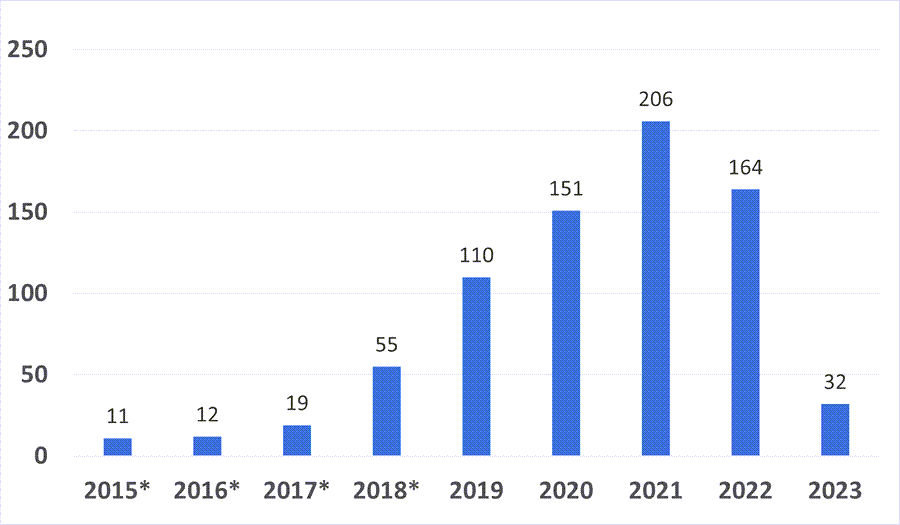
基于美国医疗器械在全球的领先地位,FDA的“突破性设备”事实上代表了全球医疗器械创新的顶尖水平。不过,入选“突破性设备”名单之后,距离真正获批上市还有一段距离。从2015年至今,一共也仅有62款“突破性设备”获得了FDA的上市批准,通过率仅有8.9%。在去年一共有19款“突破性设备”最终获准上市。
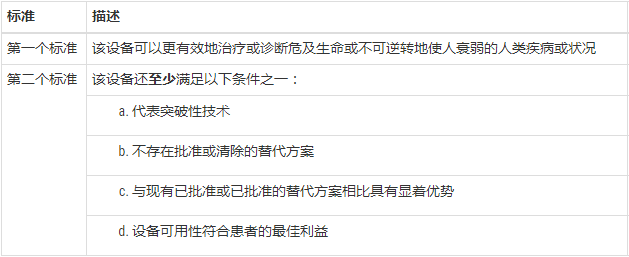
FDA突破性设备认证标准
以下是部分今年获批突破性设备的国内项目。
大医集团——x/γ射线一体化放射治疗系统
认定时间:2023年3月7日
TAICHI是一款创新放射治疗产品,此前已经获中国国家药监局(NMPA)批准上市。将医用直线加速器、伽玛射线立体定向放射外科系统以及锥形束CT进行同机整合,既可用于多种适应症的单独放射治疗,也可组合起来完成复杂的放射治疗。
该产品通过对多种治疗模式的灵活应用,能够根据患者的个体化差异给每一位患者带来适合的、疗效较好的个性化放射治疗,确保患者利益的最大化。
鹍远生物——胰腺癌液体活检技术PDACatch
认定时间:2023年5月8日
PDACatch是一种新型的基于DNA甲基化、用于检测高风险人群中胰腺癌的液体活检检测技术。是首个辅助检测胰腺癌的液体活检工具;对于高危人群的早期检测和监测将对该人群生活质量产生重大影响。
自2014年成立以来,鹍远生物以攻克癌症早期筛查与诊断为目标,基于分子诊断技术开发了一系列肿瘤和遗传疾病的基因检测解决方案。公司在上海和美国圣地亚哥设有研发基地;在上海和扬州设有生产基地。
上海奕谱生物科技——尿路上皮癌检测产品
认定时间:2023年5月中旬
全球首个获得美国FDA突破性医疗器械认定的自主研发的基于全癌标志物的尿路上皮癌(膀胱癌、输尿管癌和肾盂癌)尿液同步检测产品。
采用全基因组 DNA 甲基化检测方法GPS (Guide Positioning Sequencing),即“导向定位测序”。基于GPS 技术对全基因组DNA高精度和高覆盖度的甲基化检测,找到了在肿瘤中共有的一类甲基化位点,并在全球首次提出“全癌标志物” (Universal Cancer Only Marker, UCOM) 概念,进而发现了一系列TAGMe®全癌肿瘤标志物,目前已发现57个全癌标志物检测靶标。
博动医疗公司——第四代 μFR ®系统
认定时间:2023 年 5 月 26 日
μFR 是一种基于血管的生理评估工具,无需压力线或充血剂。它的适应症范围更广,价格也更实惠。μFR® 可用于整个 PCI 过程,包括 PCI 前的精确生理评估、手术期间的策略优化、PCI 后的结果和微循环功能评估。
公司成立于2015年,位于中国上海,致力于开发用于泛血管疾病患者精准诊断和优化治疗的创新技术。开创并发明了 μFR® 的关键算法——一种从多个成像数据中快速计算血流储备分数 (FFR) 的方法。
中精普康——PrecogColo Dx 早期CRC血检
认定时间:2023年6月9日
基于血清代谢检测的结直肠癌及进展期腺瘤早筛检测,是中精普康推出的首款用于结直肠癌早期发现的血检,已获得国际专利(专利序号:US11462305B2)、国内专利(国内专利序号ZL202080030060.1)。
从进展期腺瘤到I、II期结直肠癌,早长静®的敏感性和特异性均比肩国际标杆企业Freenome及Guardant health 同期发布的数据,其临床检测性能位于世界第一梯队,为国内首个自主研发的多组学结直肠早期肿瘤血检。
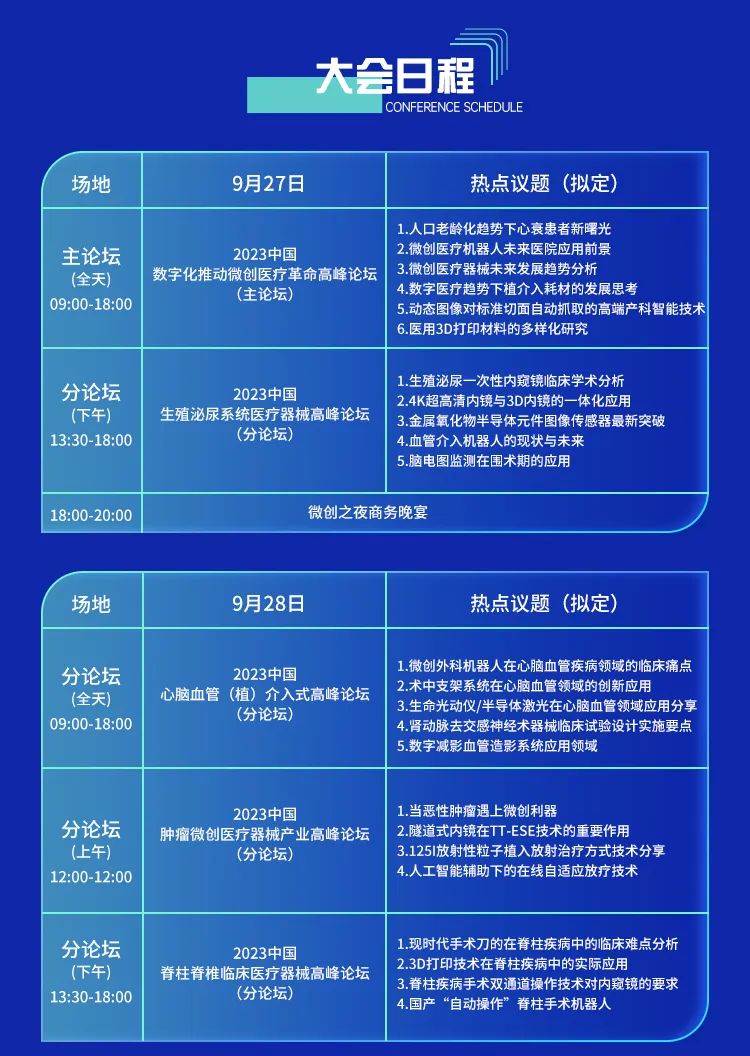
2023中国微创医疗产业大会
近年来,随着数字化技术的发展,医疗行业也面临着巨大的变革。微创技术作为一种创新的治疗方法,受到了越来越多医生在治疗过程中首选和推崇的治疗方式。随着数字化医疗技术的发展,数字化医疗技术正在赋能微创技术,使治疗过程更加方便、高效、减少病患痛苦。本次论坛将探讨微创技术数字化的趋势、机遇和挑战,分享数字化医疗技术在微创领域的应用与前景,旨在激发更多医疗机构开展微创技术数字化的探索与实践,推动数字化医疗技术在微创领域的创新与发展。我们邀请了微创技术专家、数字化医疗领域的从业者、学者、著名企业家及资深媒体代表等参加本次论坛,共同为数字化时代下微创技术的发展探路、出谋划策。